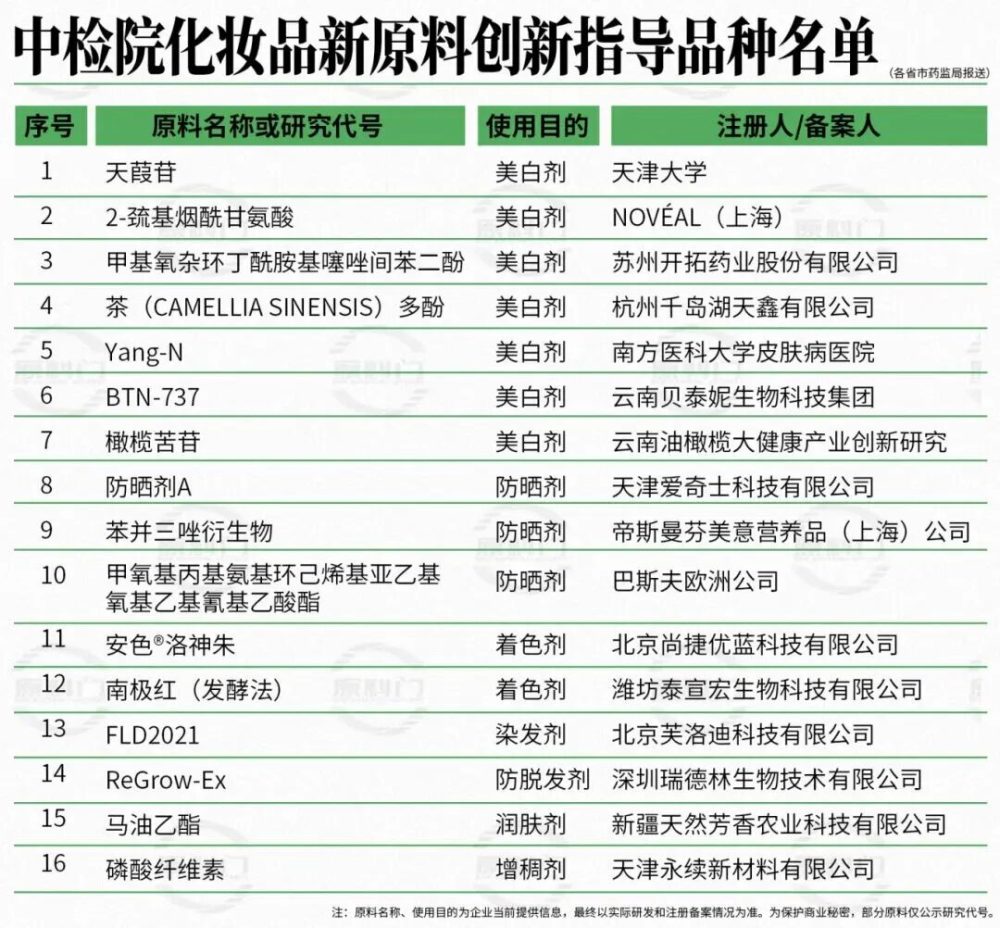
12月
根据国家药品监督管理局要求
一批新规新政将正式实施
或进入关键执行阶段
其中包括
出口药品档案填报功能即将开放
执业药师差异化配备过渡期将到期
广东药品和医用耗材采购管理工作有新依据
此外 还有
1种处方药转换为非处方药
1项药品说明书要求有变化
2项新修订和1项新制定行业标准将实施
2项行业标准将废止
牙膏备案人需完善备案资料
部分超声手术附件需完成注册证转换
快来看看哪些与你息息相关吧~
| 药 品 |
出口药品档案填报功能,2025年12月1日起开放
国家药监局发布的《国家药监局关于发布药品生产企业出口药品检查和出口证明管理规定的公告(2025年第113号)》将于2026年1月1日起施行。其中,药品业务应用系统(信息采集类)用于填报《规定》第十四条第(一)至(十三)项所要求的信息和材料,用户可在“帮助文档”中获取操作手册,了解具体操作流程。该系统于2025年12月1日起面向全国各省份开放出口药品档案填报功能。
相关阅读:《药品生产企业出口药品检查和出口证明管理规定》发布!内含解读→
执业药师差异化配备过渡期将到期
国家药监局发布的《国家药监局关于规范药品零售企业配备使用执业药师的通知》(以下简称《通知》)要求“原则上,经营处方药、甲类非处方药的药品零售企业,应当配备执业药师;只经营乙类非处方药的药品零售企业,应当配备经过药品监督管理部门组织考核合格的业务人员。”《通知》允许各地结合实际情况制定差异化配备政策并设置过渡期,但过渡期不超过2025年。
相关阅读:执业药师差异化配备使用政策出台!
广东省《关于进一步完善药品和医用耗材采购工作的指导意见的通知》,2025年12月1日起实施
广东省医疗保障局 广东省卫生健康委员会 广东省药品监督管理局印发《关于进一步完善药品和医用耗材采购工作的指导意见的通知》自2025年12月1日起实施,有效期5年。
相关阅读:https://hsa.gd.gov.cn/zwgk/content/post_4794837.html
经前舒颗粒和复方太子参口服液转换为非处方药,2025年12月27日前备案
国家药监局发布的《国家药监局关于经前舒颗粒和复方太子参口服液转换为非处方药的公告(2025年第34号)》(以下简称《公告》),要求上述药品的上市许可持有人按照《公告》及其附件要求修订说明书,并于2025年12月27日前,就修订说明书事项向省级药品监督管理部门备案。品种名单及其非处方药说明书范本随《公告》一并发布。非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。自补充申请备案之日起生产的药品,不得继续使用原药品说明书。
维生素C注射剂说明书修订,2025年12月28日前备案
国家药监局发布的《国家药监局关于修订维生素C注射剂说明书的公告(2025年第98号)》(以下简称《公告》),要求上述药品的上市许可持有人按照《公告》及其附件要求修订说明书,并于2025年12月28日前备案。《公告》中的维生素C注射剂,包括维生素C注射液、注射用维生素C、维生素C葡萄糖注射液、维生素C氯化钠注射液;本次说明书修订范围包括【不良反应】【禁忌】【注意事项】。
| 化妆 品 |
牙膏备案人,2025年12月1日前按要求完善备案资料
国家药监局发布的《关于贯彻落实牙膏监管法规和简化已上市牙膏备案资料要求等有关事宜的公告(2023年第124号)》,要求简化备案的牙膏产品,备案管理部门应当按照《化妆品监督管理条例》《牙膏监督管理办法》规定,在备案人提交简化备案资料之日起5个工作日内向社会公布备案基本信息。牙膏备案人应当于2025年12月1日前,按照相关法规规定要求,整理完成相应的产品备案资料。首批产品上市销售日期在2021年1月1日之前的,产品备案资料可由备案人留档备查;首批产品上市销售日期在此后的,备案人应当通过备案平台提交完整的备案资料。此外,除仅宣称具有清洁功效的外,简化备案的牙膏产品,还应当于2025年12月1日前,通过备案平台上传并公布产品功效宣称依据的摘要。
相关阅读:国家药监局简化已上市牙膏备案资料要求
| 医疗器械 |
2项新修订行业标准,1项新制定行业标准,2025年12月1日实施
国家药监局发布的《国家药监局关于发布YY 0315—2023〈钛及钛合金牙种植体〉等13项医疗器械行业标准及7项医疗器械行业标准修改单的公告(2023年第149号)》,YY/T 0003-2023《手动病床》替代YY/T 0003-1990《病床》、YY/T 0969—2023《一次性使用医用口罩》替代YY/T 0969—2013《一次性使用医用口罩》,共2项新修订行业标准;YY/T 1904—2023医用防护眼(面)罩,共1项新制定行业标准,将于2025年12月1日实施。
相关阅读:国家药监局关于发布YY 0315—2023《钛及钛合金牙种植体》等13项医疗器械行业标准及7项医疗器械行业标准修改单的公告
2项行业标准,2025年12月1日废止
国家药监局发布的《国家药监局关于废止〈外科植入物 金属材料 第7部分:可锻和冷加工的钴-铬-镍-钼-铁合金〉等3项医疗器械行业标准的公告(2025年第69号)》中,YY/T 0772.3—2009《外科植入物 超高分子量聚乙烯 第3部分:加速老化方法》及YY/T 0772.5—2009《外科植入物 超高分子量聚乙烯 第5部分:形态评价方法》,共2项行业标准,将于2025年12月1日废止。
相关阅读:YY/T 0605.7—2007《外科植入物 金属材料 第7部分:可锻和冷加工的钴-铬-镍-钼-铁合金》等3项行业标准废除
部分超声手术附件,2025年12月31日前需完成注册证转换
国家药监局发布的《国家药监局关于调整〈医疗器械分类目录〉部分内容的公告(2023年第101号)》(以下简称《公告》)中,对于附件中调整涉及的01-01-03“超声手术设备附件”中作为第三类医疗器械管理的“超声切割止血刀头、超声软组织手术刀头、超声吸引手术刀头”和01-10-06“乳腺旋切活检系统及附件”中“乳房旋切穿刺针及配件”,依照《公告》要求申请注册证延期的,原医疗器械注册证有效期不得超过2025年12月31日。自2026年1月1日起,该类产品未依法取得第三类医疗器械注册证不得生产、进口和销售。
文章转自:广东药监公众号
发稿/咨询/合作联系:13710470565(微信)
相关文章